元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A.元素原子的最外层电予数等于元素的最高化合价 |
| B.电子层数相同的主族元素,最外层电子数多的原子半径小 |
| C.K、Mg、Al失电子能力和最高价氧化物水化物的碱性均依次增强 |
D.第三周期元素中,最外层电子数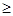 电子层数的为非金属元素 电子层数的为非金属元素 |
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A.元素原子的最外层电予数等于元素的最高化合价 |
| B.电子层数相同的主族元素,最外层电子数多的原子半径小 |
| C.K、Mg、Al失电子能力和最高价氧化物水化物的碱性均依次增强 |
D.第三周期元素中,最外层电子数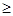 电子层数的为非金属元素 电子层数的为非金属元素 |