对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是 ( )
pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是 ( ) 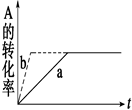
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m∶n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当 重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q
D.加催化剂或增大压强,可实现右图中a―→b的变化
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是 ( )
pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是 ( ) 
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m∶n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当 重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q
D.加催化剂或增大压强,可实现右图中a―→b的变化