一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:

(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时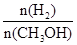 增大 增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是____________________________________________(用化学方程式表示)。