现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):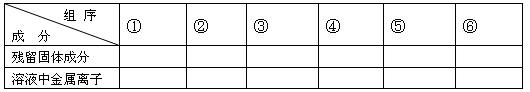
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。