(共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分
|
NaCl
|
Mg(OH)2
|
CaCO3
|
BaSO4
|
其他不溶物
|
质量分数(%)
|
15~20
|
15~20
|
5~10
|
30~40
|
10~15
|
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
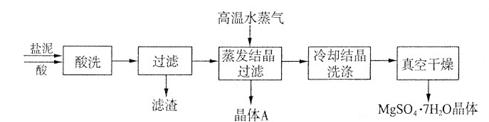
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。
②过滤所得滤渣的主要成分为____________________________。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。

④真空干燥MgSO4·7H2O晶体的原因是______________________。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。
 ③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是 (填序号,下同),遇到KSCN溶液能变红的是 ,易与空气中氧气反应的是 ,通常状况下呈黄绿色的是 。
③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是 (填序号,下同),遇到KSCN溶液能变红的是 ,易与空气中氧气反应的是 ,通常状况下呈黄绿色的是 。 ③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是 (填序号,下同),遇到KSCN溶液能变红的是 ,易与空气中氧气反应的是 ,通常状况下呈黄绿色的是 。
③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是 (填序号,下同),遇到KSCN溶液能变红的是 ,易与空气中氧气反应的是 ,通常状况下呈黄绿色的是 。