下图是一些常见 单质、化合物之间的转化关系图。有些反应中的部分物质及反应条
单质、化合物之间的转化关系图。有些反应中的部分物质及反应条 件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,I和K的组成元素相同,I在常温下是无色无味有毒气体,K气体能使澄清石灰水浑浊,J是黑色粉末,G是一种红色金属单质。
件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,I和K的组成元素相同,I在常温下是无色无味有毒气体,K气体能使澄清石灰水浑浊,J是黑色粉末,G是一种红色金属单质。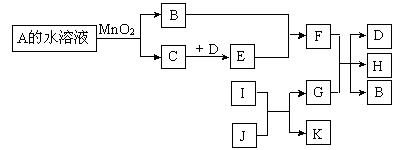
(1)A的化学式是 。
(2)B的电子式是 。
(3)若D能使品红溶液褪色,且加热后溶液又恢复红色,则F和G反应的化学方程式为 。
(4)若D 是无色气体,且常温下遇空气变为红棕色气体,则J和F反应的离子方程式为 。
是无色气体,且常温下遇空气变为红棕色气体,则J和F反应的离子方程式为 。
下图是一些常见 单质、化合物之间的转化关系图。有些反应中的部分物质及反应条
单质、化合物之间的转化关系图。有些反应中的部分物质及反应条 件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,I和K的组成元素相同,I在常温下是无色无味有毒气体,K气体能使澄清石灰水浑浊,J是黑色粉末,G是一种红色金属单质。
件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,I和K的组成元素相同,I在常温下是无色无味有毒气体,K气体能使澄清石灰水浑浊,J是黑色粉末,G是一种红色金属单质。
(1)A的化学式是 。
(2)B的电子式是 。
(3)若D能使品红溶液褪色,且加热后溶液又恢复红色,则F和G反应的化学方程式为 。
(4)若D 是无色气体,且常温下遇空气变为红棕色气体,则J和F反应的离子方程式为 。
是无色气体,且常温下遇空气变为红棕色气体,则J和F反应的离子方程式为 。