红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。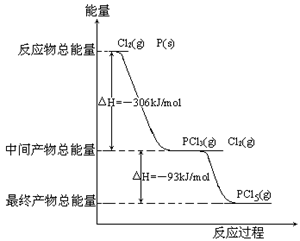
根据上图回答下列问题:
(1)P和Cl2反应生成PCl5(g)的热化学方程式
(2)PCl5(g)分解成PCl3(g)和Cl2的热化学方程式
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入1.60molPCl5,反应达到平衡时PCl5有1.20mol,其分解率α1,若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,则α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________。
(4)P和Cl2分两步反应生成1molPCl5的焓变为△H3,P和Cl2一步反应生成1molPCl5的焓变为△H4,则△H4______△H3(填“大于”、“小于”或“等于”)。
(5)以红磷P(s)和Cl2(g)制备PCl5,为提高Cl2(g)的转化率可采用的措施是:
(任填两种措施)

 RCOOH
RCOOH
 粤公网安备 44130202000953号
粤公网安备 44130202000953号