某河道两旁有甲、乙两厂。它们 排放的工
排放的工 业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO
业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO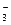 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____ ___、_____ ___、_____ __。
(2)乙厂的废水中含有另外三种离子。如果加一定量___ _____(选填“活性炭”“铁粉”),可以回收其中的______ __ (填写金属元素符号)。
(填写金属元素符号)。
某河道两旁有甲、乙两厂。它们 排放的工
排放的工 业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO
业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO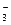 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____ ___、_____ ___、_____ __。
(2)乙厂的废水中含有另外三种离子。如果加一定量___ _____(选填“活性炭”“铁粉”),可以回收其中的______ __ (填写金属元素符号)。
(填写金属元素符号)。