如图A、B、C、D、E、F六种物质中除D为单质外其余 均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。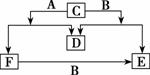
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;
(2)C的电子式是____________________;
(3)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
如图A、B、C、D、E、F六种物质中除D为单质外其余 均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;
(2)C的电子式是____________________;
(3)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。