在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
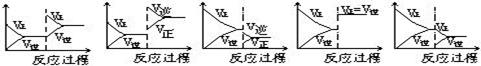
| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是 (4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断

| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是 (4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是