【化学——选修2:化学与技术】
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在反应器中碱性条件下用氧气氧化KnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示: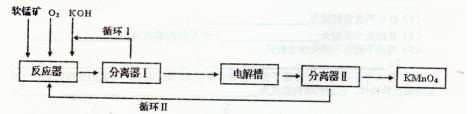
回答下列问题:
(1)写出反应器中反应的方程式_______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因____。
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:_______ :阳极:____。
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:
K2MnO4+_______CO2=" _______KMnO4+_______ " MnO2+ _______K2CO3
将所得到的KMnO4配成0.1mol·L-1KMnO4溶液,滴定20.00 rnL未知浓度的FeCl2液,消耗KMnO4溶液30.00 mL。滴定达到终点时的现象为:_______ ,则FeCl2溶液的浓度为_______mol/L。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号