随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)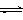 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。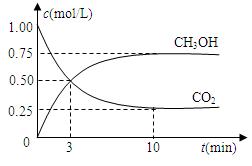
(1)从反应开始到10min,氢气的平均反应速率v(H2)=
(2)下列说法正确的是
| A.进行到3分钟时,正反应速率和逆反应速率相等。 |
| B.10分钟后容器中压强不再改变。 |
| C.达到平衡后,再充入氩气反应速率不会改变。 |
| D.3min前v正>v逆,3min后v正<v逆。 |
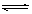 CH3OH(g)△H= -90.8kJ/mol
CH3OH(g)△H= -90.8kJ/mol _________
_________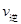 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。 CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下: =__________。
=__________。 、
、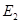 的代数式表示)。
的代数式表示)。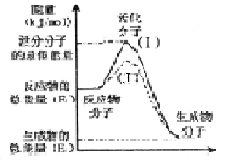
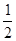 O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号