实验室利用如图装置进行中和热的测定。回答下列问题: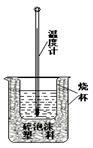
⑴该图中有两处实验用品未画出,它们是________________、____________________;
⑵在操作正确的前提下提高中和热测定的准确性的关键是:_________________________
⑶如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将________ (填“偏大”、“偏小”、“不变”)原因是______________________________________
实验室利用如图装置进行中和热的测定。回答下列问题:
⑴该图中有两处实验用品未画出,它们是________________、____________________;
⑵在操作正确的前提下提高中和热测定的准确性的关键是:_________________________
⑶如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将________ (填“偏大”、“偏小”、“不变”)原因是______________________________________