下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+ H2O Zn(OH)2+2Ag;(正反应过程)_________ ____
Zn(OH)2+2Ag;(正反应过程)_________ ____
(2)2C2H2+5O2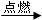 4CO2+2H2O; _________ _____
4CO2+2H2O; _________ _____
(3) ; _____ _________
; _____ _________
(4)CaCO3 CaO+CO2↑;_____ _________
CaO+CO2↑;_____ _________
下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+ H2O Zn(OH)2+2Ag;(正反应过程)_________ ____
Zn(OH)2+2Ag;(正反应过程)_________ ____
(2)2C2H2+5O2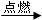 4CO2+2H2O; _________ _____
4CO2+2H2O; _________ _____
(3) ; _____ _________
; _____ _________
(4)CaCO3 CaO+CO2↑;_____ _________
CaO+CO2↑;_____ _________