固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g) + 3H2(g)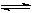 CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1
CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):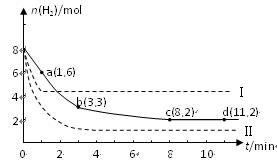
回答下列问题:
(1)该反应在 条件下能自发进行(填编号)。
A、高温 B、低温 C、任何温度
(2)该反应在0~8 min内CO2的平均反应速率是 mol/(L•min)。
(3)该反应的平衡常数K= 。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条
件下平衡常数为K2,则K、K1和K2的大小关系是 。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益


 Cu +H2O
Cu +H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号