(1)某元素的原子结构示意图为: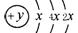 ,该元素符号为_______
,该元素符号为_______ 在周期表位于 。
在周期表位于 。
(2)写出下列物质的用电子式:
MgCl2:_____________。CO2:_______________。KOH________________。
(1)某元素的原子结构示意图为: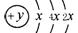 ,该元素符号为_______
,该元素符号为_______ 在周期表位于 。
在周期表位于 。
(2)写出下列物质的用电子式:
MgCl2:_____________。CO2:_______________。KOH________________。