根据下列叙述,画出对应1--3的微粒结构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍: 。
(2)与Ar原子电子层结构相同的-1价阴离子: 。
(3)质量数为23,中子数为12的原子 。
(4)写出下列物质的名称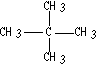 ___________
___________
(5)C5H12的同分异构体有 种
根据下列叙述,画出对应1--3的微粒结构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍: 。
(2)与Ar原子电子层结构相同的-1价阴离子: 。
(3)质量数为23,中子数为12的原子 。
(4)写出下列物质的名称 ___________
___________
(5)C5H12的同分异构体有 种