工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H (g)
(g) CH
CH OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H
OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H 和一定量的CO后,CO和CH
和一定量的CO后,CO和CH OH(g)的浓度随时间变化。请回答下列问题:
OH(g)的浓度随时间变化。请回答下列问题:
(1)在“图1”中,曲线______(填:a或b)表示使用了催化剂;该反应属于____________(填:吸热、放热)反应。
(2)下列说法正确的是____________________。
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
D.保持温度和密闭容器容积不变,再充入1molCO和2molH ,再次达到平衡时n(CH3OH)/n(CO)会减小 ,再次达到平衡时n(CH3OH)/n(CO)会减小 |
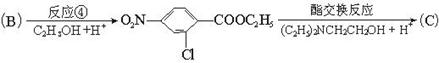
(3)从反应开始到建立平衡,v(H )=__________;该温度下CO(g)+2H
)=__________;该温度下CO(g)+2H (g)
(g) CH
CH OH(g)的化学平衡常数为____________________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数__________(填“增大”、“减小”或“不变”)。
OH(g)的化学平衡常数为____________________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数__________(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线。要求画压强不同的2条曲线(在曲线上标出P 、P
、P ,且P
,且P <P
<P )。
)。
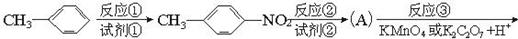
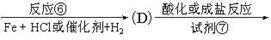

 2Fe2O3+8SO24FeS+7O2
2Fe2O3+8SO24FeS+7O2
 WI2(g)
WI2(g)

 CH3CH2OH(l)+H2O(l) 的△H=。
CH3CH2OH(l)+H2O(l) 的△H=。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号