X,Y,Z,W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y﹑W均相邻,Y﹑Z和W三种元素的原子最外层电子数之和为17,且Z﹑W最外层电子数相同则:(每小题2分,共4分)
(1) 用电子式表示X与Y所组成化合物的形成过程
(2) W在周期表中的位置是
(3) 已知,在101kPa时,X单质在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,则表示X单质燃烧热的热化学方程式为__________。
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表: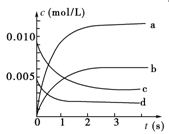
 2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。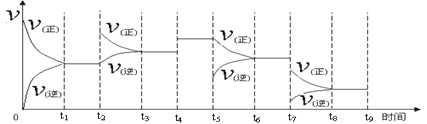
 H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)Ac(I2)B;平衡时HI的分解率αAαB;平衡时H2在混合气体中的体积分数AB (填写“>”“<”“=”)
H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)Ac(I2)B;平衡时HI的分解率αAαB;平衡时H2在混合气体中的体积分数AB (填写“>”“<”“=”) H++A-,回答下列问题:
H++A-,回答下列问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号