(1)A.B.C.D.E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示,请回答下列问题:
①这五种化合物中,互为同分异构体的是_____________。
②(备注:①采取了某种氧化剂,使分子中烯键不起反应。)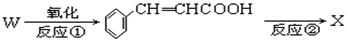
Ⅰ、以上反应式中的W是A~E中的某一化合物,则W是___________。
Ⅱ、X是D的同分异构体,X的结构简式是_________________。反应②属于__________反应。
(2)苯甲酸的银镜反应方程式
(1)A.B.C.D.E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示,请回答下列问题:
①这五种化合物中,互为同分异构体的是_____________。
②(备注:①采取了某种氧化剂,使分子中烯键不起反应。)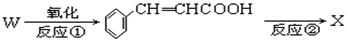
Ⅰ、以上反应式中的W是A~E中的某一化合物,则W是___________。
Ⅱ、X是D的同分异构体,X的结构简式是_________________。反应②属于__________反应。
(2)苯甲酸的银镜反应方程式