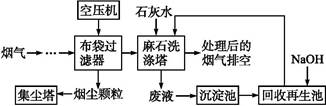
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1) 某温度下,将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2(10分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
⑴达到平衡所需要的时间:t(A) t(B),
⑵达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向 反应方向移动,B中的化学反应速率 。
⑶达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量 ,B容器中SO2的百分含量 。

 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低) ;② 。
;② 。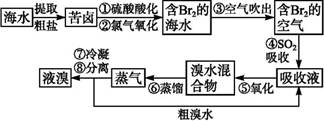
 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0 粤公网安备 44130202000953号
粤公网安备 44130202000953号