I.(1)CH3OH(1)、H2的燃烧热分别为:725.5 kJ/mol和285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH(1)的热化学方程式: 。
(2)右图为光电解水的装置,写出光照时半导体电极表面发生的电极反应式________。目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是 (填字母)。
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全贮存、运输
II.将0.2mol/L HA溶液与O.lmol/L NaOH溶液等体积混合,测得混合溶液c(Na+)>c(A—),
用“>”、“<”或“=”填写下列空白:
(1)混合溶液中c(A—)____c(HA);c(HA)+c(A—)__0.lmol/L;
(2)混合溶液中,由水电离出来的c(OH—) 0.2mol/L HA溶液中由水电离出的c(H+)
(3)25℃时,如果取0.2mol/L HB溶液与0.lmol/L NaOH溶液等体积混合,测得混合溶液的pH <7,则HB的电离程度 NaB的水解程度。
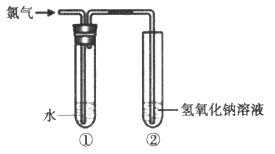
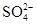 等杂质,选用的试剂是①盐酸 ②BaCl2 ③NaOH ④Na2CO3
等杂质,选用的试剂是①盐酸 ②BaCl2 ③NaOH ④Na2CO3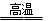 Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成_____mol Si,转移电子的物质的量为 mol。
Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成_____mol Si,转移电子的物质的量为 mol。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号