氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。 (2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是 。
(3)已知:
| |
CH4 |
SiH4 |
NH3 |
PH3 |
| 沸点(K) |
101.7[ |
161.2 |
239.7 |
185.4 |
| 分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
_____________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
___________________________________________________________。
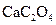 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作: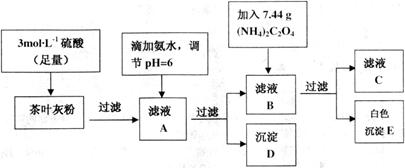
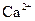

 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: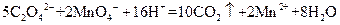 。
。
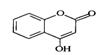 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成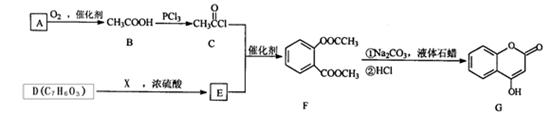
 __,E原子的配位数为:____。
__,E原子的配位数为:____。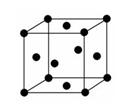
 。
。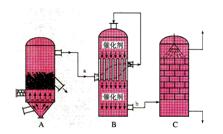

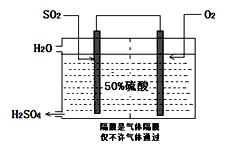
 氨碱法”中CO2来源于;
氨碱法”中CO2来源于; Fe(s)+CO2(g) ΔH >0
Fe(s)+CO2(g) ΔH >0 CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。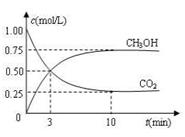
 增大的是______(填符号)。
增大的是______(填符号)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号