有机合成粘合剂是生产和生活中一类重要的材料。黏合的过程一般是呈液态的粘合剂小分子,经化学反应转化为大分子或高分子而固化。
(1)“520胶”是一种快干胶,其成分为α氰基丙烯酸乙酯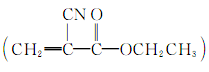 ,当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可把被粘物牢牢粘在一起。请写出“520胶”发生粘合作用的化学方程式:
,当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可把被粘物牢牢粘在一起。请写出“520胶”发生粘合作用的化学方程式:
________________________________________________________________________。
(2)厌氧胶(主要成分为
 是另一种粘合剂,它与“520胶”不同,可在空气中长期储存,但在隔绝空气(缺氧)时,分子中的双键断开发生聚合而固化。在工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂,则这一制取过程的化学方程式为________________________________________________________________________
是另一种粘合剂,它与“520胶”不同,可在空气中长期储存,但在隔绝空气(缺氧)时,分子中的双键断开发生聚合而固化。在工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂,则这一制取过程的化学方程式为________________________________________________________________________
________________________________________________________________________。