美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=;反应的平衡常数随温度的变化如下表:
温度/℃
|
400
|
500
|
830
|
1000
|
平衡常数K
|
10
|
9
|
1
|
|
从上表可以推断:此反应是(填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有(填实验编号);
实验编号
|
n(CO)
|
n(H2O)
|
n(H2)
|
n(CO2)
|
A
|
1
|
5
|
2
|
3
|
B
|
2
|
2
|
1
|
1
|
C
|
0.5
|
2
|
1
|
1
|
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是。
①体系的压强不再发生变化②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)逆
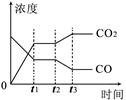
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种)。