某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压 强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体 总浓度/ mol·L-1 |
2.4× 10-3 |
3.4× 10-3 |
4.8× 10-3 |
6.8× 10-3 |
9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是( )
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)该分解反应的平衡常数表达式为____________________________,根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________________。(保留两位有效数字)
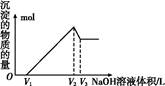
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”“减少”或“不变”);
(4)氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS________0 (填“>”“=”或“<”)。此反应在该温度下能自发进行原因是 ________ 效应大于 ___________效应.
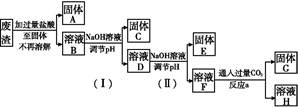
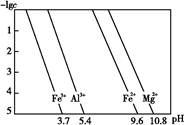
 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
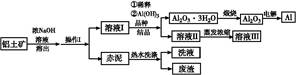
 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]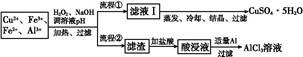
 粤公网安备 44130202000953号
粤公网安备 44130202000953号