(15分)
合成氨对化学工业和国防工业具有重要意义。
(1) 向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图。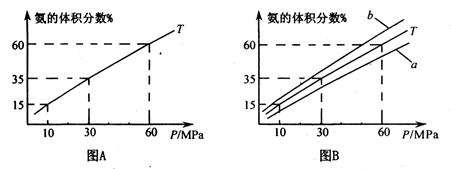
①写出工业上合成氨的化学方程式_____________________。
②图A中氨气的体积分数为15.00%时,H2的转化率="_______ " 。
③图B中T=5000C,温度为4500C对应的曲线是_______(选填字母“a"或“b ”),选择的理由是______________
④由图像知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是_______(写出一条即可)。
(2) 合成氨 所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
所需的氢气可由甲烷与水反应制得,反应的热化学方程式为: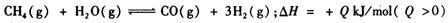
(3) 一定温度下,在2 L容器中发生上述反应,各 物质的物质的量变化如下表
物质的物质的量变化如下表
| 时间/min |
CH4(mol) |
H20( mol) |
CO (mol) |
H2 (mol) |
| 0 |
0.40 |
1.00 |
0 |
0 |
| 5 |
X1 |
X2 |
X3 |
0.60 |
| 7 |
Y1 |
Y2 |
0.20 |
Y3 |
| 10 |
0.21 |
0.81 |
0.19 |
0.62 |
①分析表中数据,判断5〜7min之间反应是否处于平衡状态____________(填“是”或“否”),
前5 min平均反应速率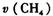 =______。
=______。
②反应在7~ 10 min之间,CO的物质的量减少的原因可能是______(填字母)。
a• 减少CH4 b•降低温度 c•增大压强 d•充入H 2
2
③若保持温度不变,向1L容器中起始充入0.15 mol CH4.0.45 mol H2O. ______mol CO、______mol H2 ,达到平衡时CH4的体积百分含量与第一次投料相同。

 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙
 CH2Br—CH===CH2+HBr属于加成反应;⑤苯使溴水褪色发生加成反应;⑥苯与液溴在三氯化铁作催化剂的条件下发生加成反应;⑦乙烷、乙醇、乙酸、苯、纤维素、油脂、蛋白质均能发生取代反应;⑧乙烯通入溴水中发生取代反应;⑨乙醇可以被氧化为乙酸,二者都能发生酯化反应。
CH2Br—CH===CH2+HBr属于加成反应;⑤苯使溴水褪色发生加成反应;⑥苯与液溴在三氯化铁作催化剂的条件下发生加成反应;⑦乙烷、乙醇、乙酸、苯、纤维素、油脂、蛋白质均能发生取代反应;⑧乙烯通入溴水中发生取代反应;⑨乙醇可以被氧化为乙酸,二者都能发生酯化反应。 粤公网安备 44130202000953号
粤公网安备 44130202000953号