(10分)葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。将A进行如下图所示的反应。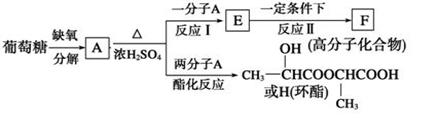
回答下列问题:
(1)写出结构简式:F____________,H________________。
(2)写出下列转化的化学方程式:
E―→F____________________________________________________;
A―→H____________________________________________________。
(10分)葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。将A进行如下图所示的反应。
回答下列问题:
(1)写出结构简式:F____________,H________________。
(2)写出下列转化的化学方程式:
E―→F____________________________________________________;
A―→H____________________________________________________。