面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的主要方向。
(1) “生物质”是由植物或动物生命体衍生得到的物质的总和。生物质能主要是指用树木、庄稼、草类等植物直接或间接提供的能量.秸秆、杂草等废弃物经微生物发酵之后,便可以产生沼气,利用沼气是解决人类能源危机的重要途径之一。下面说法不正确的是( )
| A.利用生物质能就是间接利用太阳能,生物质能是可再生能源 |
| B.生物质能是解决农村能源的重要途径之一 |
| C.生物质能的缺点是严重污染环境 |
| D.若建立沼气发电站,则可以实现把生物质能转化为电能 |
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为 -890.3 KJ·mol-1、-285.8 KJ·mol-1、-283.0 KJ·mol-1,则该重整的热化学方式为 ;
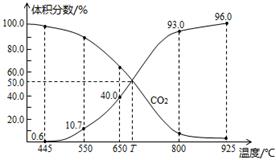
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:
C(s) +CO2(g ) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。
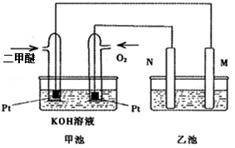
(4)如下图是一个二甲醚(CH3OCH3)燃料电池工作时的示意图,
①若乙池为粗铜的电解精炼,电解质为硫酸铜,则N电极材料为 。
②若乙池中M、N为惰性电极,电解质为足量硝酸银溶液,写出乙池中电解的化学方程式 。乙池中某一电极析出金属银2.16g时,溶液的体积为200mL,则常温下乙池中溶液的pH为 。
③通入二甲醚的铂电极的电极反应式为 。若该电池的理论输出电压为1.0V,则该电池的能量密度= kW·h·kg-1(结果保留小数点后一位).(能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=9.65×l04C·mol-1 )。