甲醇是一种可再生能源,具有广泛的开发和应用前景。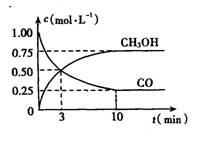
(1)工业上一般采用如下反应合成甲醇:
CO(g)+2H2(g) CH2O H(g)△H= xkJ/mo①右图是反应时CO和CH3 0H的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=__ __。
②下表所列数据是该反应在不同温度下的化学平衡
常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断x 0(填“<”、“<”填“=”)
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2mol/L,则CO的转化率为____。
(2)已知在常温常压下
①2CH3OH(1)+3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6kJ/mol
②2CO(g)+O2(g) 2CO2(g)△H=—566.0kJ/mol
③H2O(g) H2O(1) △H=—44.0kJ/mol
请计算1mol甲醇不完全燃烧生成lmolCO和液态水放出的热量为____。
(3)利用甲醇燃料电池设计如右图所示的装置:
则该装置中b为____极;Cu极的电极反应式为____。
当铜片的质量变化为25.6g时,a极上消耗的O2在标准状况下的体积为_ __L。
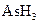 、
、 、
、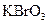 、
、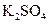 、
、 、
、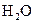 和一种未知物质X。
和一种未知物质X。
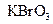 在反应中得到1mol电子生成X,则X的化学式为。
在反应中得到1mol电子生成X,则X的化学式为。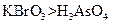 b.氧化性:
b.氧化性: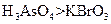
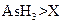 d.还原性:
d.还原性:
 式,并标出电子转移的方向
式,并标出电子转移的方向

 uSO4、K2CO3、NaCl、Na2SO4、K
uSO4、K2CO3、NaCl、Na2SO4、K NO3中的一种或几种,为判断其组成,进行如下实验:①取少量该白色粉末溶于水,产生白色沉淀,上层清液为无色;②取上层清液滴在pH试纸上,pH>7;③过滤,往得到的白色沉淀中滴入稀盐酸,白色沉淀部分溶解。则该白色粉末中一定含有_____________________,一定没有_________,可能含有________________________。
NO3中的一种或几种,为判断其组成,进行如下实验:①取少量该白色粉末溶于水,产生白色沉淀,上层清液为无色;②取上层清液滴在pH试纸上,pH>7;③过滤,往得到的白色沉淀中滴入稀盐酸,白色沉淀部分溶解。则该白色粉末中一定含有_____________________,一定没有_________,可能含有________________________。 式;
式; 粤公网安备 44130202000953号
粤公网安备 44130202000953号