吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如图。
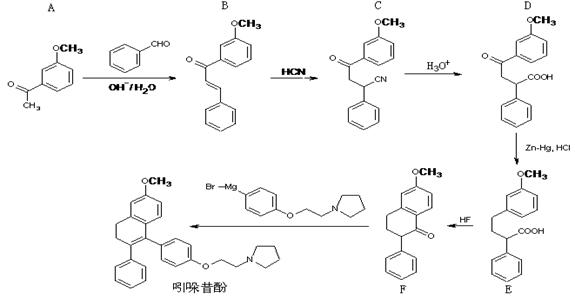
(1)化合物A的分子式是,1molA最多能与H2发生反应
(2)反应类型:B→C; D→E
(3)D中含氧官能团有:(写名称)。
(4)化合物E能发生的反应类型是(填入序号)
| A.加成反应 |
B.酯化反应 |
C.水解反应 |
D.加聚反应 |
(5)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六元环,G 结构简式为:。
(6)满足下列四个条件的A的同分异构体数目有种。
①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色;④不与氢氧化钠水溶液反应
(7)2,2-二甲基戊酸[CH3CH2CH2C(CH3)2COOH]是有机合成中间体,请设计合理的方案以丙酮(CH3COCH3)为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,注明反应条件)
提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;
③合成路线流程图示例:CH3CH2OH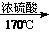 CH2=CH2
CH2=CH2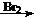 CH2Br-CH2Br
CH2Br-CH2Br