在有机溶剂里若m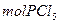 跟m
跟m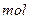
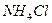 定量地发生完全反应,生成
定量地发生完全反应,生成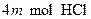 ,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下
,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下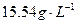 。试回答:
。试回答:
(1)通过计算推导R的化学式。
(2)分子结构测定表明,R分子为环状,且同种元素的原子在R分子中化合价相同,用单键“—”和双键“=”把分子里的原子连起来,写出R分子的结构式。
在有机溶剂里若m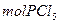 跟m
跟m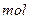
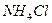 定量地发生完全反应,生成
定量地发生完全反应,生成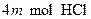 ,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下
,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下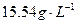 。试回答:
。试回答:
(1)通过计算推导R的化学式。
(2)分子结构测定表明,R分子为环状,且同种元素的原子在R分子中化合价相同,用单键“—”和双键“=”把分子里的原子连起来,写出R分子的结构式。