工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)为确认Q的存在,需在装置中添加M于 (填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(5)如果气体Y中含有H2,预计实验现象应是 。
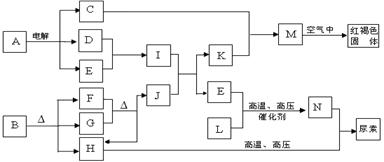
 Ⅰ.MnFe2O4的制备:
Ⅰ.MnFe2O4的制备:

 上投入原料Fe(NO3)3和Mn(NO3)2
上投入原料Fe(NO3)3和Mn(NO3)2 O2(g);△H1
O2(g);△H1 。
。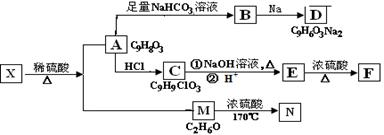
 有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下O2112L。
有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下O2112L。
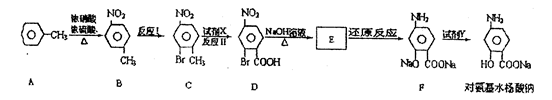
 。
。 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为,在这四种物质中含有极性键的非极分子内 键和
键和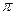 键的比为。
键的比为。 对,则[Cu(NH3)n]+中n的值为
对,则[Cu(NH3)n]+中n的值为 。
。 粤公网安备 44130202000953号
粤公网安备 44130202000953号