某同学设计了一种电解法制取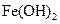 的实验装置(如
的实验装置(如 图)。玻璃管内的电解液为
图)。玻璃管内的电解液为 溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
(1)写出A电极的电极反应式_________;B电极的电极反应式__________;
(2)若电解改用 溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用
溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用 溶液作电解液时白色沉淀能保持较长时间的原因_____________。
溶液作电解液时白色沉淀能保持较长时间的原因_____________。
某同学设计了一种电解法制取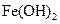 的实验装置(如
的实验装置(如 图)。玻璃管内的电解液为
图)。玻璃管内的电解液为 溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
(1)写出A电极的电极反应式_________;B电极的电极反应式__________;
(2)若电解改用 溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用
溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用 溶液作电解液时白色沉淀能保持较长时间的原因_____________。
溶液作电解液时白色沉淀能保持较长时间的原因_____________。