某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为c mol/L的标准NaOH溶液对其进行滴定。
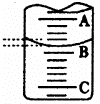
(1)如图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
实验次数
|
第一次
|
第二次
|
第三次
|
消耗NaOH溶液体积/mL
|
26.02
|
25.35
|
25.30
|
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(用实验原始数据列式,不必化简):c= 。
 收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为 。(不考虑N2O4的存在)
收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为 。(不考虑N2O4的存在) 收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为 。(不考虑N2O4的存在)
收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为 。(不考虑N2O4的存在)