已知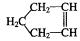 可简写为:
可简写为: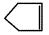 ;又已知降冰片烯的分子结构可表示为:
;又已知降冰片烯的分子结构可表示为: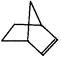
回答下列问题:
(1)降冰 片烯属于__________。
片烯属于__________。
A、环烃 B、不饱和烃 C、烷烃 D、芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4 )降冰片烯不具有的性质__________。
)降冰片烯不具有的性质__________。
A、能溶于水 B、能发生氧化反应
C、能发生加成反应 D、常温常压下为气体
已知 可简写为:
可简写为: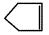 ;又已知降冰片烯的分子结构可表示为:
;又已知降冰片烯的分子结构可表示为:
回答下列问题:
(1)降冰 片烯属于__________。
片烯属于__________。
A、环烃 B、不饱和烃 C、烷烃 D、芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4 )降冰片烯不具有的性质__________。
)降冰片烯不具有的性质__________。
A、能溶于水 B、能发生氧化反应
C、能发生加成反应 D、常温常压下为气体