某混合 物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: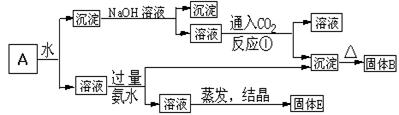
据此判断 :
:
(1)固体B所含物质的化学式为 ;
(2)固体E所含物质的化学式为 ;
(3)反应①的化学方程式为 。
某混合 物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此判断 :
:
(1)固体B所含物质的化学式为 ;
(2)固体E所含物质的化学式为 ;
(3)反应①的化学方程式为 。