、(1)如下图横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量,若向硫
酸铝溶液中加入氢氧化钠溶液至过量,沉淀的变化符合A~C中的________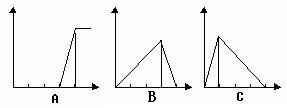
(2)现向1mol/L 100ml的AlCl3溶液中加入一定浓度的NaOH溶液100ml,充分反应后,得到3.9g沉淀,则NaOH溶液的物质的量浓度为________________________
、(1)如下图横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量,若向硫
酸铝溶液中加入氢氧化钠溶液至过量,沉淀的变化符合A~C中的________
(2)现向1mol/L 100ml的AlCl3溶液中加入一定浓度的NaOH溶液100ml,充分反应后,得到3.9g沉淀,则NaOH溶液的物质的量浓度为________________________