1)49 g硫酸的物质的量为 mol,若在水中完全电离可产生 molH+ , ______mol
molH+ , ______mol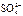 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生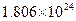 个
个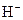 ,此硫酸的质量为 _______g.
,此硫酸的质量为 _______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是 ,相对分子质量为 ; 等物质的量的NH3与H2S质量比为 ; 1.7g氨气与 mol H2O含有的电子数相等。
1)49 g硫酸的物质的量为 mol,若在水中完全电离可产生 molH+ , ______mol
molH+ , ______mol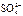 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生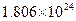 个
个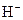 ,此硫酸的质量为 _______g.
,此硫酸的质量为 _______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是 ,相对分子质量为 ; 等物质的量的NH3与H2S质量比为 ; 1.7g氨气与 mol H2O含有的电子数相等。