硫及其化合物和氮及其化合物在化学工业、环境保护中应用非常广泛。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致酸雨的形成,收集SO2形成的酸雨,pH逐渐减小,一定时间后pH不再变化,写出酸雨中反应的离子方程式 。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。己知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3l kJ·mol-1
2NO(g)+O2(g)=2NO2(g)ΔH=-112.97 kJ·mol-1
写出CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: 。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,已知2SO2(g)+O2(g) 2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
②一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
| A.保持温度和容器内压强不变,充入1mol Ar |
| B.保持温度和容器体积不变,充入2 mol N2 |
| C.保持温度和容器体积不变,充入2 mol SO3 |
| D.升高温度 |
E.移动活塞压缩气体
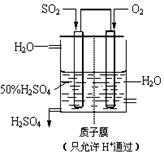
(4)某人设想以右图所示装置,用电化学原理生产硫酸,通入O2的电极为 极,写出通入SO2的电极的电极反应式 。