m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO)向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n—m)g
②恰好溶解后溶液中的NO3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为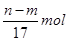
④生成NO气体的体积室温下为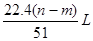
⑤与合金反应的硝酸的物质的量为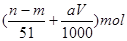
| A.2项 | B.3项 | C.4项 | D.5项 |
m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO)向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n—m)g
②恰好溶解后溶液中的NO3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为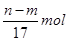
④生成NO气体的体积室温下为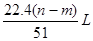
⑤与合金反应的硝酸的物质的量为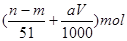
| A.2项 | B.3项 | C.4项 | D.5项 |