某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题: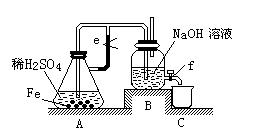
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为: ,B中可以观察到的现象是 。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是 。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是 ,
有关反应的化学方程式是
某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题:
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为: ,B中可以观察到的现象是 。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是 。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是 ,
有关反应的化学方程式是