有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
⑴、写出由A、C、D三种元素形成的化合物的的电子式为 ▲ ,该化合物的化学键类型为 ▲ ,晶体类型为 ▲ 。
⑵、B的氢化物的沸点比同主族其他氢化物的沸点高,这可用 ▲ 来解释。
A.极性分子 B.氢键 C.共价键 D.离子键
⑶、D2E溶液呈 ▲ (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 ▲ 。
⑷、0.5L 0.1 mol/L D的最高价氧化物的水化物与0.25L0.1 mol/LE的最高价氧化物的水化物反应放出2865 J的热量,该反应的热化学方程式为 ▲ 。
⑸、由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极的电极反应离子方程式为 ▲ 。
 Y2O3(g),其平衡常数表达式为K=。
Y2O3(g),其平衡常数表达式为K=。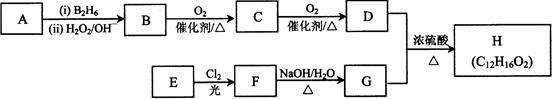
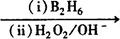 R-CH2-CH2OH
R-CH2-CH2OH



 粤公网安备 44130202000953号
粤公网安备 44130202000953号