有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。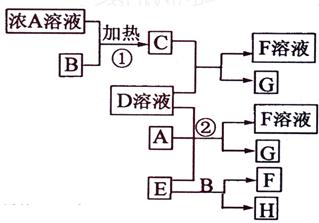
请 回答下列问题:
回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
请 回答下列问题:
回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式