已知A可用做果实催熟剂,A的产量是衡量一个国家石油化工生产水平的重要标志。F的结构简式为CH 2=CHCl,G为高分子化合物。
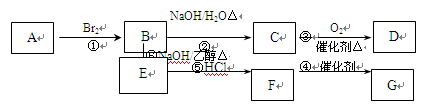
请分析后回答下列问题:
(1)E的结构式是。
(2)上述反应中属于加成反应的有。(填序号)
(3)依次写出反应②、③、④的化学方程式
_______________________________________________ _______;
_______________________________________________ _______;
______________________________________________________。