已知 可简写为
可简写为 。降冰片烯的分子结构可表示为
。降冰片烯的分子结构可表示为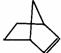 :
:
(1)降冰片烯属于__________。
A. 环烃 B. 不饱和烃 C. 烷烃 D. 芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯不具有的性质__________。
A.能溶于水 B.发生氧化反应 C.加成反应 D.常温常压下为气体
已知 可简写为
可简写为 。降冰片烯的分子结构可表示为
。降冰片烯的分子结构可表示为 :
:
(1)降冰片烯属于__________。
A. 环烃 B. 不饱和烃 C. 烷烃 D. 芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯不具有的性质__________。
A.能溶于水 B.发生氧化反应 C.加成反应 D.常温常压下为气体