右图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题: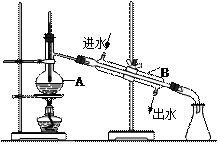
⑴ 图中两处明显的错误是:
,
。
⑵ A仪器的名称是 ,B仪器的名称是 。
,B仪器的名称是 。
⑶ 实验时A中除加入适量自来水外,还需加入少量 ,其作用是 。
右图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题:
⑴ 图中两处明显的错误是:
,
。
⑵ A仪器的名称是 ,B仪器的名称是 。
,B仪器的名称是 。
⑶ 实验时A中除加入适量自来水外,还需加入少量 ,其作用是 。