设水的电离平衡线如右图所示。 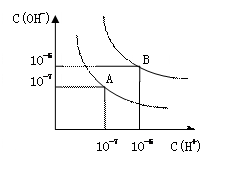
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温
度升高到100℃时,水的电离平衡状态到B点,则此时水的离子
积从___________增加到____________; A
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐
酸的体积比为__________。
设水的电离平衡线如右图所示。 
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温
度升高到100℃时,水的电离平衡状态到B点,则此时水的离子
积从___________增加到____________; A
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐
酸的体积比为__________。