氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称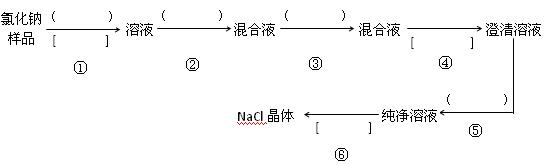
写出有关反应的化学方程式:
第②步
第③步
第⑤步
氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第②步
第③步
第⑤步