已知卤代烃在氢氧化钠溶液中可以发生如下反应: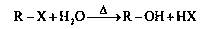
某芳香烃A有如下七步转化,按要求填空: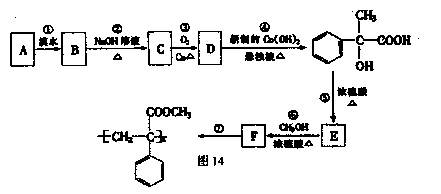
(1)写出反应类型:反应① ;反应⑦
(2)写出结构简式:A ;F
(3)写出化学方程式:
反应③
反应⑤
已知卤代烃在氢氧化钠溶液中可以发生如下反应:
某芳香烃A有如下七步转化,按要求填空:
(1)写出反应类型:反应① ;反应⑦
(2)写出结构简式:A ;F
(3)写出化学方程式:
反应③
反应⑤